Химические задачки, которые теперь решаются иначе (6 фото)
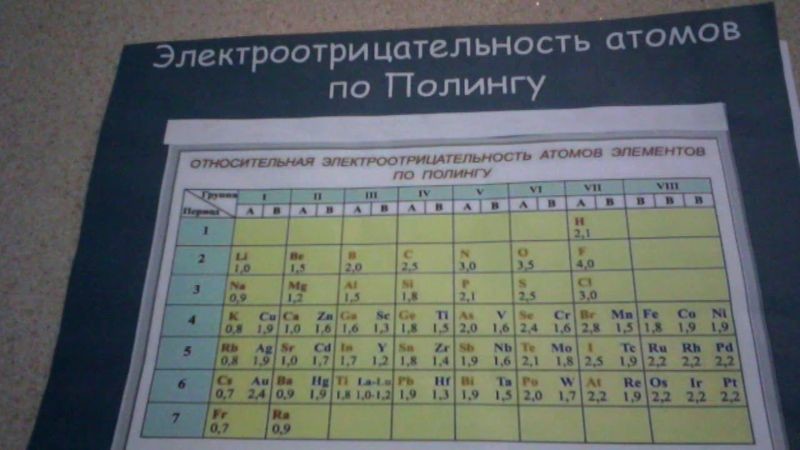
Всем, кто не пропускал уроки химии,наверняка, знакома эта шкала. А теперь забудьте все, что вы знали и познакомьтесь с новой ее версией.
![]()
Российские ученые разработали новую шкалу электроотрицательности атомов. Почему к разработке шкалы такое внимание, и чем не угодила предыдущая?
Электроотрицательность
![]()
Если вы закончили 9 классов школы, то с понятием электроотрицательность вы контактировали на уроках химии. Под понятием электроотрицательности понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Проще говоря, чем выше электроотрицательность атома, тем сильнее он будет к себе притягивать электроны другого атома при взаимодействии.
Как совсем обыденно себе представить это? Чем выше электроотрицательность элемента, тем слабее проявляются металлические свойства. То есть, тем хуже, например, электропроводность элемента.
Чем не устроила предыдущая?
![]()
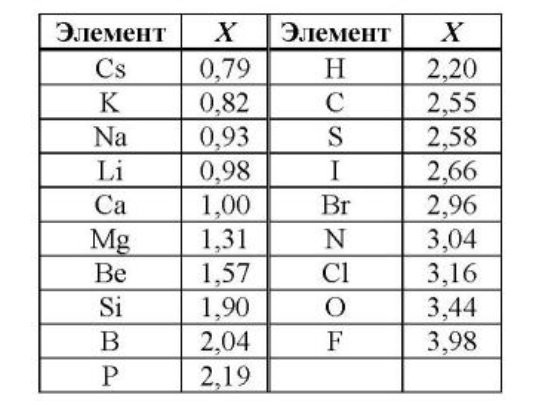
Первую шкалу электроотрицательности предложил Лайнус Полинг в 1932 году. Долгое время именно его расчёты брались за основу. Эта же шкала применяется и в школьном курсе химии. Для решения школьных химических задач она наиболее удобная.
![]()
Но химикам электроотрицательность необходима для учета еще большего количества свойств элементов и соединений, оценки эффективности реакций, составления прогнозов.
![]()
Именно поэтому ученые не прекращают предлагать свои варианты шкал электроотрицательности элементов, стараясь сформировать более удобные, понятные в расчетах и, самое главное, точные.
Полинг расчищал электроотрицательность лишь для 31 элемента, а затем, на основании этих значений, получил электроотрицательность других элементов периодической таблицы Менделеева. В шкале Полинга некоторые элементы имеют одинаковую электроотрицательность, что не совсем логично, ведь все элементы обладают разными свойствами. К тому же, не учитывается экспериментальная энергия связи, что ведет к неточностям на практике.
Новая шкала
![]()
Шкала электроотрицательности наших ученых учитывает теоретические и экспериментальные энергии связи, а также одинаково хорошо работает как при высоком, так и при низком давлении. Это позволит правильно предсказать характер взаимодействия как похожих атомов, так и абсолютно разных элементов.
Российские ученые разработали новую шкалу электроотрицательности атомов. Почему к разработке шкалы такое внимание, и чем не угодила предыдущая?
Электроотрицательность
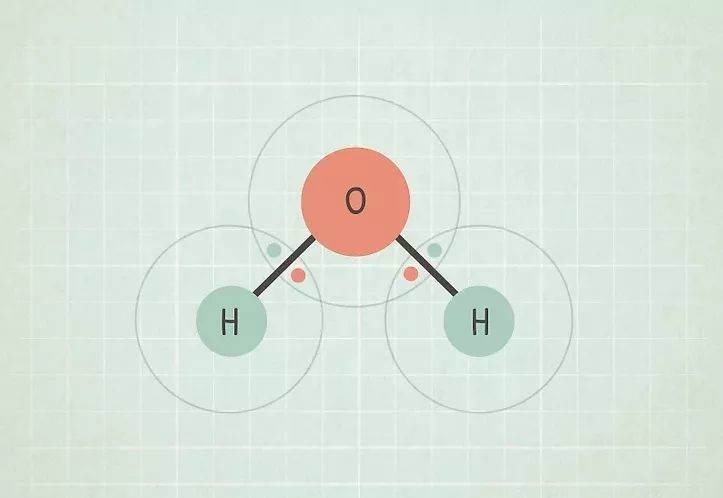
Если вы закончили 9 классов школы, то с понятием электроотрицательность вы контактировали на уроках химии. Под понятием электроотрицательности понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Проще говоря, чем выше электроотрицательность атома, тем сильнее он будет к себе притягивать электроны другого атома при взаимодействии.
Как совсем обыденно себе представить это? Чем выше электроотрицательность элемента, тем слабее проявляются металлические свойства. То есть, тем хуже, например, электропроводность элемента.
Чем не устроила предыдущая?
Первую шкалу электроотрицательности предложил Лайнус Полинг в 1932 году. Долгое время именно его расчёты брались за основу. Эта же шкала применяется и в школьном курсе химии. Для решения школьных химических задач она наиболее удобная.
Но химикам электроотрицательность необходима для учета еще большего количества свойств элементов и соединений, оценки эффективности реакций, составления прогнозов.

Именно поэтому ученые не прекращают предлагать свои варианты шкал электроотрицательности элементов, стараясь сформировать более удобные, понятные в расчетах и, самое главное, точные.
Полинг расчищал электроотрицательность лишь для 31 элемента, а затем, на основании этих значений, получил электроотрицательность других элементов периодической таблицы Менделеева. В шкале Полинга некоторые элементы имеют одинаковую электроотрицательность, что не совсем логично, ведь все элементы обладают разными свойствами. К тому же, не учитывается экспериментальная энергия связи, что ведет к неточностям на практике.
Новая шкала

Шкала электроотрицательности наших ученых учитывает теоретические и экспериментальные энергии связи, а также одинаково хорошо работает как при высоком, так и при низком давлении. Это позволит правильно предсказать характер взаимодействия как похожих атомов, так и абсолютно разных элементов.